3月23日,中国国家药监局药品审评中心(CDE)官网公示,绿叶制药申请的注射用芦比替定拟纳入优先审评,适用于以铂类为基础的化疗中或化疗后肿瘤进展的转移性小细胞肺癌成人患者的治疗。公开资料显示,芦比替定(lurbinectedin)是一种选择性的致癌基因转录抑制剂,已在美国、澳大利亚、加拿大等地获批上市,用于治疗转移性小细胞肺癌成年患者。绿叶制药拥有芦比替定的中国权益。
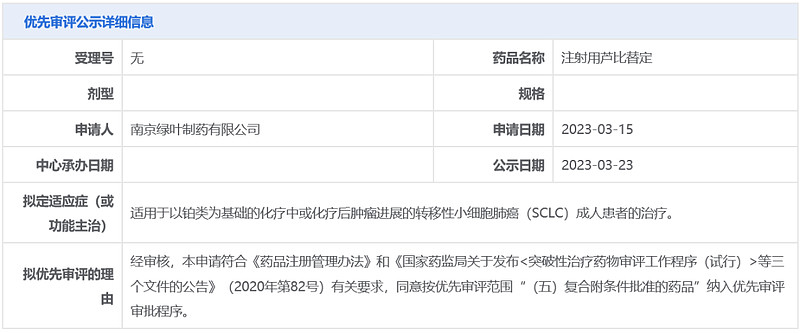
截图来源:CDE官网
据绿叶制药早期新闻稿介绍,芦比替定是从海鞘ecteinacidia turbinata中分离出的海洋化合物ET-736的衍生物,ET-736中的氢原子被甲氧基取代。该产品能够选择性地抑制多种肿瘤所依赖的致癌基因转录。除了其对癌细胞的直接作用,芦比替定还能够抑制肿瘤相关巨噬细胞的转录过程,以及下调对肿瘤生长至关重要的细胞因子的产生。
公开资料显示,芦比替定最初由PharmaMar公司开发。2019年,Jazz Pharmaceuticals与PharmaMar公司达成数额为10亿美元的合作,获得该产品的开发和推广权益。同年,绿叶制药与PharmaMar公司达成授权研发合作协议,获得在中国开发及商业化芦比替定的独家权利,用于治疗包括小细胞肺癌在内该药物的所有适应症。2022年8月,芦比替定作为临床急需药品正式落地海南博鳌乐城,用于治疗小细胞肺癌成年患者。
此次芦比替定拟纳入优先审评,针对适应症是以铂类为基础的化疗中或化疗后肿瘤进展的转移性小细胞肺癌成人患者。此前,芦比替定二线治疗中国小细胞肺癌患者研究结果发布于2022年中国临床肿瘤学会(CSCO)学术年会。此项研究为在中国开展的单臂、包含剂量递增及扩展的临床研究,其中扩展阶段将已明确的推荐剂量用于一线铂类化疗失败后的复发性SCLC患者,以评估芦比替定在此类人群中的有效性和安全性等指标。
在CSCO学术年会上发布的主要研究结果显示:推荐剂量(3.2mg/m2、1小时静脉输注、每3周1次)的芦比替定已在中国SCLC患者群体的二线治疗中展现出较好的抗肿瘤疗效:由独立评估委员会评估确认的总有效率(ORR)达到45.5%,疾病控制率(DCR)为90.9%,中位缓解持续时间(mDOR)为4.2个月,中位无进展生存期(mPFS)为5.6个月。此外,芦比替定表现出可控的安全性,且其药代动力学(PK)特征与海外2期篮子试验的海外人群相似。
小细胞肺癌(SCLC)是一种高级别神经内分泌癌,约占肺癌的15%。该疾病确诊时多为晚期,预后极差,五年生存率仅7%,广泛期小细胞肺癌患者的五年生存率仅3%。大多数小细胞肺癌患者会在初始治疗后出现复发及耐药,该疾病的高复发为其治疗带来巨大挑战,临床亟需创新治疗方案。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发,谢绝媒体或机构未经授权以任何形式转载至其他平台。